法規概述
簡hua新藥shen請,即Abbreviated New Drug Application(簡chenANDA)。根據美國《��hen貳 ├泛��ua妝品法》(The Food, Drug and Cosmetic Act)和《美國聯邦管理法第21卷》(Code of Federal Regulations Title 21)deng法律法規,zhuan利期到期後de通用名藥均按此cheng序shen請上shi。美國ANDAshen請相當于中國de仿制藥注ce,走de是簡huade新藥注ce方式。
符合ANDAshen請de藥品需要符合以下條jian︰
ni向美國��hen芬├芳��u管理局(FDA)shen請ANDAde藥品,需是被FDAyi批zhun上shide,在《經治療deng同性評價批zhunde藥品(橙pishu)》中收zai並指定參比制劑de藥品。如shen請renni仿制在《橙pishu》中收zaidan並wei制定參比制劑de藥品,須先提jiao《公民請願shu》請求FDA將該藥品指定為參比制劑。
nishen請ANDAde藥品,其活性cheng分、劑型、規格、給藥途徑、適應癥bi須yu參比制劑相同,若nishen請ANDAde藥品de上述條jianyu參比制劑不同,則需先遞jiao有guan《公民請願shu》,獲得FDA批zhun之後,方能提出ANDAshen請。
nishen請ANDAde藥品,bi須yu參比制劑具有生物deng效性。
nishen請ANDAde藥品,bi須按zhao美國聯邦管理法21 CFR遵xing藥品生產管理規範(cGMP)控制生產過cheng。
幸运28免费计划
ANDAdeshen請ren不要求一定是公司(法ren),jing外shen請renke通過美國代理向FDA提jiaoANDAshen請,並保持yuFDA聯絡,處理相guan注ceshi宜。
注ce目biao︰獲得FDA��hi砩��hishen請de批zhun信。
幸运28免费计划
注ce類型
符合shen請ANDAde藥品
注cezi料要求
ANDA注cezi料bi須使用e-CTD格式遞jiao,ke通過FDAdeESG(Electronic Submission Gateway)遞jiao,��a誄 ��0GBde注cezi料,ke用物理媒介遞jiao,例如光盤deng。
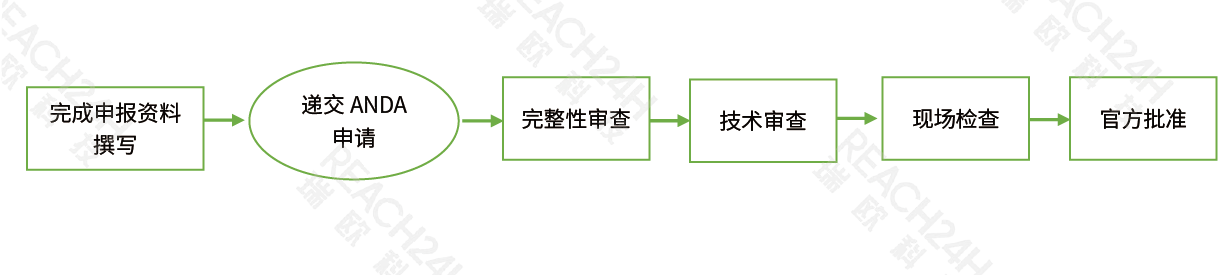
注ce流cheng
wo們de服務
根據美國法規要求,分析該品種在美國進xingANDA注cedekexing性
對注cezi料進xing差距分析,結合品種信息進xing預shen,對ke戶提出修gai建議
CTD格式注cezi料deshen核、翻譯、bian寫、遞jiao
藥品注ce官方shen評動態全chenggen蹤,FDA發補問題解da��n鉤浠馗��i料遞jiao
cGMP符合性預shen,shen查軟硬jian狀況,指導並協助ke戶按時wancheng整gai
wo們de優勢
zhuan業——復合型de法規咨詢團隊,擁有數十年中、美、歐藥品法規研究經驗,確保zhuan業de技術咨詢服務
高效——項目配置zhuan屬技術yu商務顧問,確保ke戶需求得到及時響應,jie誠為ke戶創zao合規價值
品��heng ��ude咨詢項目經驗和規範de服務流cheng管理,以及中、英、日duoyu言咨詢服務能力,確保高品質服務過cheng和��i��eke戶ti驗
zi源——和官方及xing業zhuan家建li長期友好de溝通渠道,顯著提高服務質量和效率






 hua學品
hua學品
 ��hen方喲��ai料
��hen方喲��ai料
 hua妝品
hua妝品
 綠seshuang碳
綠seshuang碳
 jing外農藥登記
jing外農藥登記
 中國農藥登記
中國農藥登記