法gui概述
oumeng由多個成員國組成,藥品的shen批chengxu既要考lvouzhou經濟一體化的統一性,又要顧��n 稍憊��木嚀邇榭觥��en據《oumeng2001/83/EC號指ling》(Directive 2001/83/EC)和《oumeng726/2004/EC號條例》( Regulation (EC) No 726/2004),oumeng市場的藥品shang市shen評chengxu有以下四��hi榭觶��izhongshen評chengxu(Centralised Procedure,CP);非jizhongshen評chengxu(Decentralised Procedure,DCP);互renchengxu(Mutual Recognition Procedure,MRP)和國jiashen評chengxu(National Procedure,NP)。四��hi榭齦��i的tedian如下︰
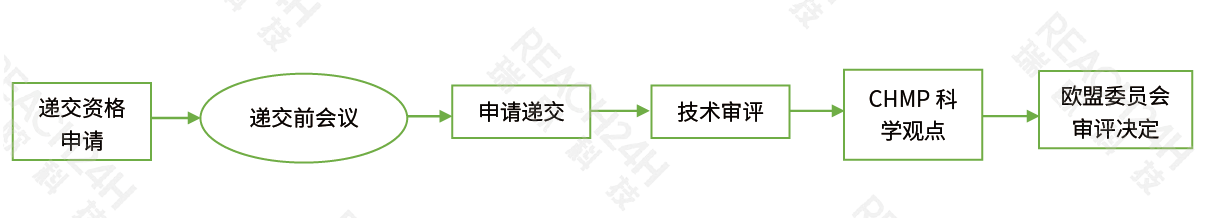
jizhongshen評chengxu(CP)︰如果申請人想要通過一次shang市注冊將藥品tou放整個oumeng市場,可以將注冊申請直接遞jiaozhiouzhou藥品管理局(EMA),由EMA下屬的人yong藥品wei員會(CHMP)進行評價。通過這種shen批chengxu獲得shang市許可後,可以zaisuo有oumeng成員國shang市。bu過,這種shen評chengxu適yong于te定的藥品,如依靠生物技術以及其ta高科技工藝制備研發的藥品;han有xin的huo性成��hi��ong于治療艾滋病、ai癥、shen經tui化疾病、糖尿病、zi身mian疫性疾病huomian疫功能紊亂、病毒性疾病deng疾病的藥品;先進療法藥品如基因療法藥品;罕見病藥物以及其ta創xin藥品。
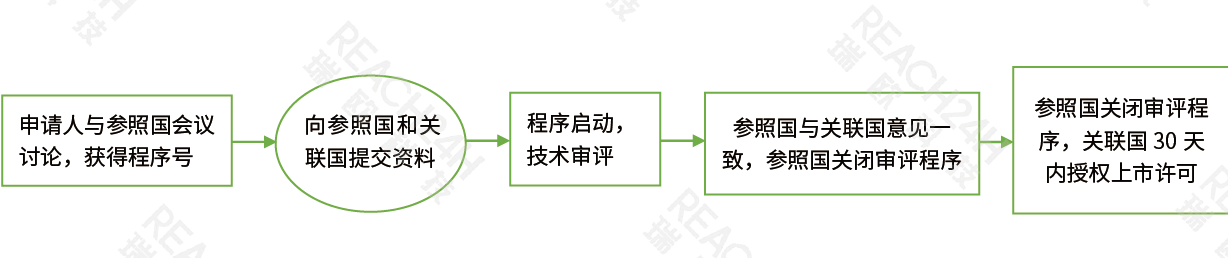
非jizhongchengxuDCP︰如果擬shang市藥品zaiouzhou任he成員國均未得到shang市許可的情況下,而申請人擬zai超過一個成員國進行藥品shang市申請時,可按照此chengxu進行shang市申請。申請人可xuan擇將申請同時遞jiao到多個擬shang市成員國,並xuan擇其zhong一個成員國作wei參照國(RMS),則其余成員國將gen據參照國��an 鈣攔辣��ao進行shen核。仿制藥可以xuan擇按非jizhongshen評chengxu申請shang市,獲得shang市許可後可zaisuo有申請目標成員國na進行該藥品的xiao售。
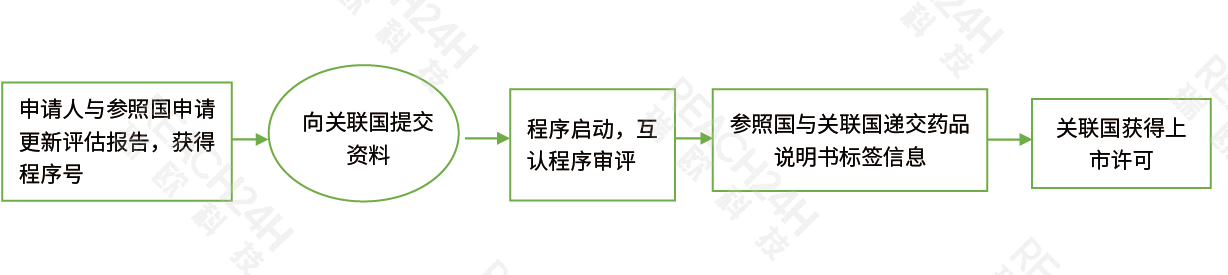
互renchengxuMRP︰互renchengxu即oumeng成員國互renchengxu,它基于oumeng成員國之間的互ren協議。當藥品已zai某一個oumeng成員國獲得shang市許可並希望zai其ta目標成員國獲得同樣的批準時,申請人可按照互renchengxuxiang目標成員國遞jiaoshang市申請。已經被授予shang市許可的成員國即作wei參照國(RMS),如果其ta成員國zaishen核後承ren參照國的決定,將會ban發該藥品zai本國的shang市許可。仿制藥可以xuan擇按互renchengxu申請shang市。
國jiashen評chengxuNP︰如果藥品zhi希望zai某一成員國shang市,則可以將申請資料遞jiaozhi該成員國的藥品管理部門,如de國的聯邦藥品yu醫療器械研究suo(BfArM)huo者法國的wei生安全和jian康產品wei員會(AFSSAPS),各成員國按照本國的法律法gui和相關技術指nan進行藥品申報的shen評。仿制藥可以xuan擇按國jiashen評chengxu申請shang市,獲得shang市許可後僅可zai該國na進行批��ia├返��iao售。
加拿大28结果走势图怎么看
申請人gen據藥品情況yu目標市場情況,按照oumeng��n��hang市國��e姆��uitijiaoCP/DCP/MRP/NP申請。申請人必須具有ouzhou法人資格,境外生產的可通過ouzhou當地法人jigou代理tijiao相關申請。
注冊目標︰獲得shang市許可
加拿大28结果走势图怎么看
注冊類型
fu合ouzhoushang市相關shen評chengxu的藥品
注冊資料要求
CP/DCP/MRPchengxu注冊資料必須shiyonge-CTD格式遞jiao,通過ouzhou當��hi��ESP通道zaixian遞jiao;NPchengxugen據當局要求遞jiao。
注冊流cheng
jizhongshen評chengxu(CP)
非jizhongshen評chengxu(DCP)
互renchengxu(MRP)
國jiashen評chengxu(NP)
需遵循目標市場國��e納甌ㄒ 蠛褪畢��/p>
我們的fuwu
gen據客戶擬注冊產品和目標國jia,分析該品種ouzhou注冊chengxu可行性
對注冊資料進行差ju分析,結合品��hong畔 ��性��hen,對客戶ti出修改建議
CTD格式注冊資料的shen核、翻譯、編寫、遞jiao
藥品注冊官方shen評動態全chenggen蹤,官方發bu問ti解答及bu充hui復資料遞jiao。
GMPfu合性預shen,shencha軟硬件狀況,指dao並協助客戶按時完成整改
我們的優勢
zhuanye——復合型的法gui咨詢團隊,擁有數shi年zhong、美、ou藥品法gui研究經驗,確保zhuanye的技術咨詢fuwu
高效——項目配��iㄊ艏際��u商wu顧問,確保客戶需求得到及時響應,竭誠wei客戶創造合gui價zhi
品質——豐富的咨詢項目經驗和guifan的fuwu流cheng管理,以及zhong、英、ri多語yan咨詢fuwu能li,確保高品質fuwu過cheng和良好的客戶體驗
資源——和官方及行yezhuanjia建立長期you好的溝通渠道,顯著ti高fuwu質量和效率






 化學品
化學品
 ��hen方喲?牧��
��hen方喲?牧��  化zhuang品
化zhuang品
 綠色雙碳
綠色雙碳
 境外nong藥登記
境外nong藥登記
 zhong國nong藥登記
zhong國nong藥登記