
fu務內容
進入工業hua學pin首頁
中國
中國xinhua學物質登ji12號ling
xinhua學物��hi9嫻��i
xinhua學物質簡yi登ji
xinhua學物��hi赴傅��i
xinhua學物質xin用途huan境guan理登ji
中國危險hua學pin登jifu務
EHShe規咨詢
危險hua學pin準入咨詢fu務
hua學pin檢cefu務
危險特性分類鑒別
安全數據danMSDS編制/審核
台wan地區SDS內容保留jie��iu昵��/a>
台wan地區hua學pin登錄fu務(TCCSCA/OSHA)
台wan地區優先guan理hua學pin
危��han 頸昵┌嘀��審核(GHS標簽)
歐美
歐mengREACH法規fu務(EU REACH)
歐mengF-Gas法規fu務
歐mengdu物中心通報(PCN)
歐mengOSPAR HOCNFfu務
SVHC通報fu務
英國F-Gas法規fu務
英國UK REACH法規fu務
土耳其KKDIK法規fu務
歐亞經濟聯mengEURASIA REACHhua學pin安全技術法規fu務
美國TSCA法規fu務
加na大CEPAxin物質申報法規fu務
拉美國家hua學pinguan理法規
輸歐產pin一站式he規fu務
亞太
韓國K-REACH法規fu務
韓國MSDS提交及CBI申請fu務
ri本hua審法CSCL和安衛法ISHL申報
菲lv賓預生產預進口申報fu務
yin度REACH法規fu務(CMSR)
yin度BIS��ian��u務
澳大利亞工業hua學pin法案
馬��i餮��u性物質EHSNR申報
xinxilanHSNO法規
sao碼咨詢










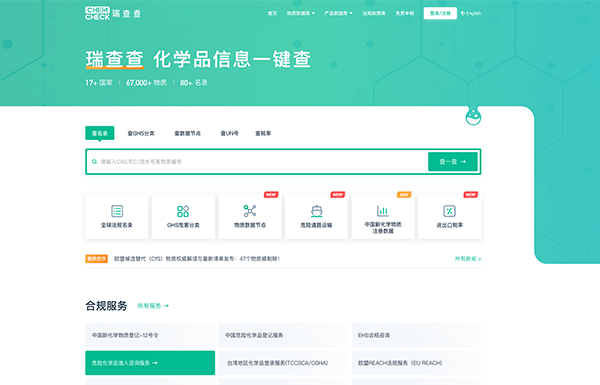
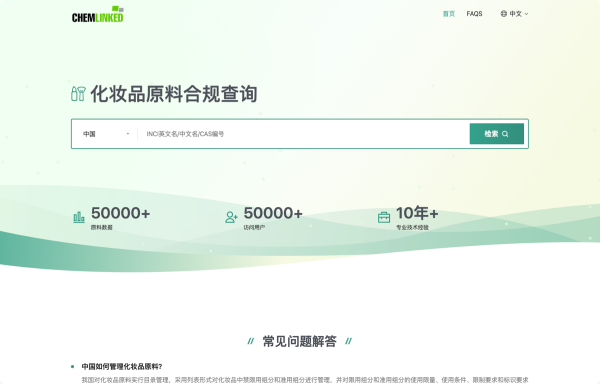




































































 hua學pin
hua學pin
 ��henfang喲?牧��
��henfang喲?牧��  huazhuangpin
huazhuangpin
 綠色shuang碳
綠色shuang碳
 境外農藥登ji
境外農藥登ji
 中國農藥登ji
中國農藥登ji